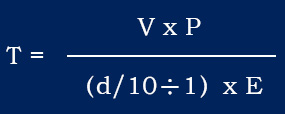|
|
|
|
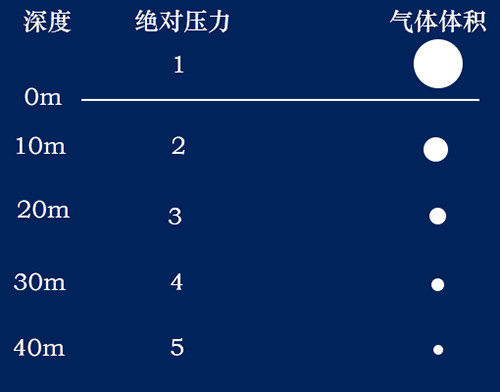
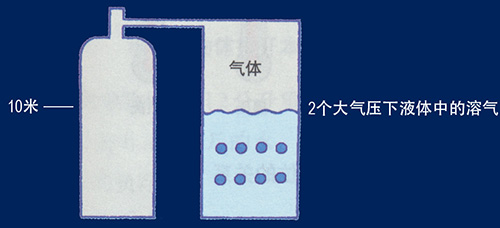
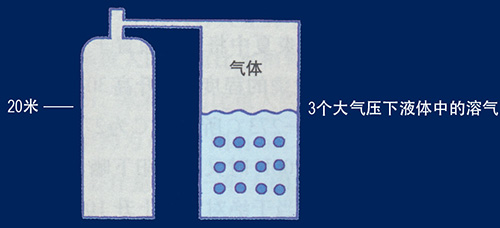
一、波義耳定律(Boyles law,又稱 Mariottes Law) 在定量定溫下,理想氣體的體積與氣體的壓力成反比。這是由英國化學家波義耳(Boyle)在1662年根據實驗結果提出的。 水是不可壓縮的流體,空氣是可壓縮的氣體。在恒溫下氣體的體積和壓力(絕對壓力)成反比。設溫度一定,氣缸內部壓力為P1容積為V1,經壓縮後變為壓力P2容積V2。 P1*V1=P2*V2=定值 波義耳定律對潛水主要有以下兩方面的影響。 水深和氣體的體積 由波義耳定律得知氣體體積和壓力成反比,所以水越深,氣體的體積就越小。水面體積為一的氣體,在水深10米時,壓力增加一個大氣壓,約為水面壓力的兩倍,氣體的體積則為二分之一,如果下降到20米深則為水面的三倍壓力,以此類推...... 水面(1絕對氣壓)體積為1,潛至10m(2絕對氣壓)體積為1/2,潛至20m(3絕對氣壓)體積為1/3,潛至30m(4絕對氣壓)體積為1/4,潛至40m(5絕對氣壓)體積為1/5,深度每增加10米,分母加1。 壓力條件下空氣的可使用時間 水容積10L的氣瓶充200 bar空氣,由波義耳定律計算為:10x200=2000,此時氣瓶內有2000L(2m3)的壓縮空氣。設每分鐘耗氣量為20L,在水面則為2000/20=100,即可持續呼吸100分鐘。每下潛10米增加1個大氣壓,空氣體積在10米水深時被壓縮成水面的1/2,因此這個氣瓶中的空氣只能維持50分鐘的呼吸,到20米水深時33分鐘就會耗盡氣瓶內的空氣。下潛和上浮過程中消耗的空氣也要計算在內,所以實際可呼吸的時間會更短。計算公式如下: T:潛水時間(分鐘) V:氣瓶容積 P:氣瓶充填壓力 E:一個大氣壓下每分鐘耗氣量(L/min) d:潛水深度 依照波義耳定律在相反的情況下,如果在30米深(4個大氣壓)吐出2L的氣體,浮到水面時因周圍壓力減小就會膨脹成8L,為原體積的4倍。下表為深度和絕對壓力對氣體體積變化及潛水滯留時間的影響。 |
|
|
水深 |
絕對壓力 |
氣體體積 |
潛水滯留時間 |
|
0 |
1 |
1(基準) |
100 |
|
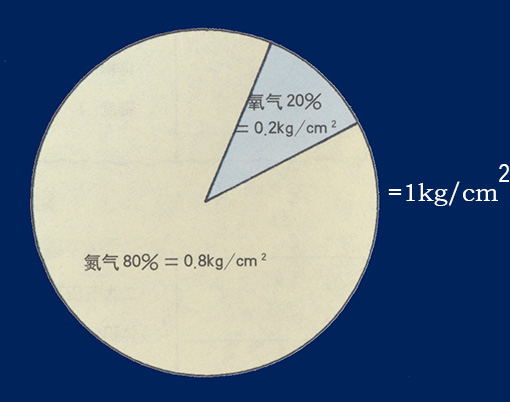
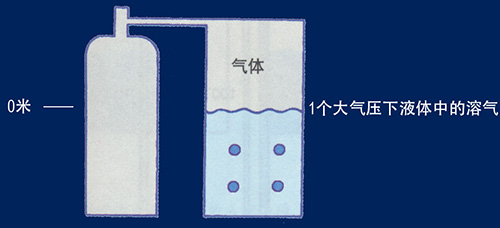
二、道爾頓定律(Daltons Law,又稱氣體分壓定律) 這一經驗定律是1801年由約翰·道爾頓觀察得到的。在溫度和體積恒定時,混合氣體的總壓力等於各組分氣體分壓力之和,各組分氣體的分壓力等於該氣體單獨佔有總體積時所表現的壓力。 空氣中氮氣與氧氣的分壓 例如氮分壓為0.8 Bar,氧分壓為0.2 Bar,依壓力變化的情形如下: 1個大氣壓 = 1 Bar 氮氣分壓0.8 x 1 = 0.8 Bar 氧氣分壓0.2 x 1 = 0.2 Bar 空氣總壓力0.8 + 0.2 = 1 Bar 水深10米2個大氣壓時為2 Bar所以: 氮氣分壓0.8 x 2 = 1.6 Bar 氧氣分壓0.2 x 2 = 0.4 Bar 空氣總壓力1.6 + 0.4 = 2 Bar(2個大氣壓) 進一步,水深90米的總壓力為10 Bar,其中氮氣分壓為8 Bar,氧氣分壓為2 Bar。氮分壓在8 Bar時會使人產生嚴重的氮麻醉,而氧分壓在2 Bar時即會使人發生氧中毒(呼吸30分鐘會致人死亡),所以如果用氧氣2%,氮氣8%,氦氣90%的混合氣體在90米的深海呼吸,10個大氣壓中各氣體的分壓為: 氧氣分壓0.02 x 10 = 0.2 Bar 氮氣分壓0.08 x 10 = 0.8 Bar 氦氣分壓0.9 x 10 = 9 Bar 氣體總壓力0.2 + 0.8 + 9 = 10 Bar 氧氣和氮氣的分壓和在1個大氣壓條件下完全相等,因此不會發生氧中毒和氮麻醉,氦氣在一定限度的壓力下對人體無害,所以氦氣被用來進行深海潛水。 三、亨利定律(Henrys Law) 亨利定律是物理化學的基本定律之一,可陳述為&ldquo在一定溫度的密封容器內,氣體的分壓與該氣體溶在溶液內的摩爾濃度成正比&rdquo。它是英國的W·亨利在1803年研究氣體在液體中的溶解度規律時發現的。 氣體有溶於液體的特性,氣體和液體接觸時氣體分子借助于分子運動會彌散溶入液體直至飽和。在一定溫度和1個大氣壓條件下,一種氣體溶解於某種液體中的毫升數稱為該氣體在那種液體中的溶解係數。溶解係數隨溫度改變,與氣體分壓成正比。亨利定律就是解釋此現象的定律。 水深增加時氮氣分壓隨之增高,氮氣溶入血液和組織的量也增多。如水深10米處為2個大氣壓,氣體溶入人體的量也翻倍。 在30米深度長時間潛水,因氮分壓為1個大氣壓時的4倍,不經減壓而急速上浮,過飽和的氮氣會因壓力驟減無充分時間排出體外而在身體組織中形成游離氣泡。 四、查理定律(Charles Law) 法國物理學家J.A.Charles 於1787年通過實驗發現的表達氣體壓力隨溫度而改變的規律。一定品質的任何氣體體積不變時,它的壓強跟熱力學溫度成正比(在恒溫下,氣體的體積和絕對溫度成正比)。 在同一壓力下氣體的溫度上升則體積變大,溫度下降則體積變小。如將氣體置於密閉容器裡,溫度上升時氣體受容器限制體積無法改變則壓強升高,反之壓力變小。 氣體或分子在零下273°C時,所有物質皆以固體形態呈現,此溫度成為&ldquo絕對零度&rdquo,但氦在非常接近絕對零度時仍維持液態。絕對零度增加1倍時,氣體的體積也增加1倍,溫度從絕對零度增加1度,氣體體積也隨之變化1/273。
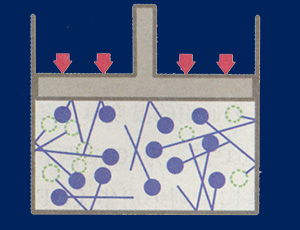
將容器內的氣體壓縮可加速分子運動使壓力上升。 加熱也可以加速分子運動使壓力上升。 五、帕斯卡定律(Pascal Law) 帕斯卡定律,是法國科學家布萊士·帕斯卡(Blaise Pascal )於1653年提出來的並利用這一原理製成水壓機。這個定律指出: a. 從液體表面來的壓力會傳導至液體的所有部位。 b. 靜止狀態的液體,任何部分的液體壓力都和所有方向相同。 c. 均勻液體的水平面所有部分的壓力相同。 水深18米處的潛水夫,穿著柔軟的潛水衣,其身體的每cm2 都承受著約1.96公斤的壓力,但一點感覺都沒有。心臟和平常一樣地跳動著,血壓也和水面測的幾乎相同,身體各器官一點也不受限制地工作著。
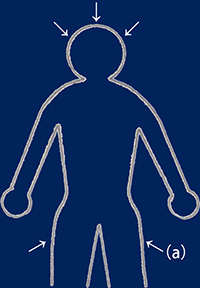
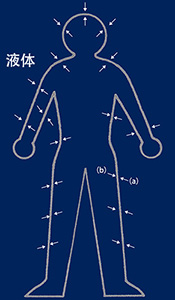
帕斯卡定律體在水中的情形,箭頭表示壓力的方向 左圖為人體在水中的情形,箭頭表示受壓的方向。假如將人體移出,人體所占的空間將被水填滿而形成右圖的情況。依照水的定律,所有方向均有反方向的相等壓力相對作用。因為人體的組織和液體有相同的作用,所以脈搏跳動,肌肉運動和血壓幾乎不受影響。但在極大壓力下身體機能會有變化,機能作用的抑制,細胞變質等等。實際上潛水時身體承受幾個大氣壓力是不成問題的。
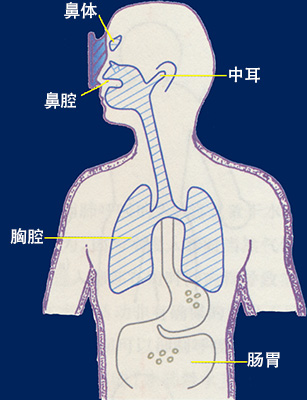
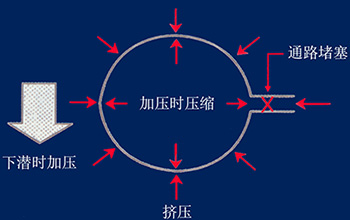
人體的空腔部位 人體內有許多空間充滿空氣。如果這些空間與外部相通的話就能與外部保持平衡。如果這些空間成封閉狀態而外部壓力增加的話,壓力將通過軟組織傳遞到空間,依波義耳定律,受壓空間會被壓縮。人體空腔被骨骼或其它應組織所包圍,如果與外界相通的管腺因發炎或被異物堵塞就會形成一個封閉的空間。當內壓低于周圍組織的壓力時則會產生周圍組織和空腔之間的壓力差,僅僅50mmHg(0.066 Bar)就能使一些組織變形,重者出現淤血,出血,浮腫,疼痛等擠壓症狀。
上浮或下潛時體內空腔管腺暢通可隨時調整壓力與外界保持平衡 擠壓 體內管腺堵塞無法平衡壓力 |
|
|